Tomes, Claudia Nora

LABORATORIO DE BIOQUÍMICA DE LA EXOCITOSIS ACROSOMAL
Nuestro laboratorio estudia los mecanismos de fusión de membranas que gobiernan la exocitosis regulada del único gránulo denso contenido en el espermatozoide. Esta exocitosis se denomina reacción acrosomal (RA), es imprescindible para la fertilidad y está mediada por proteínas evolutivamente muy conservadas. El hecho de que las proteínas (y aparentemente también los mecanismos) que gobiernan la exocitosis sean universales hace que los científicos podamos concentrar nuestros esfuerzos en unos pocos modelos secretorios adecuados y extrapolar los hallazgos a otros sistemas de más difícil escrutinio.
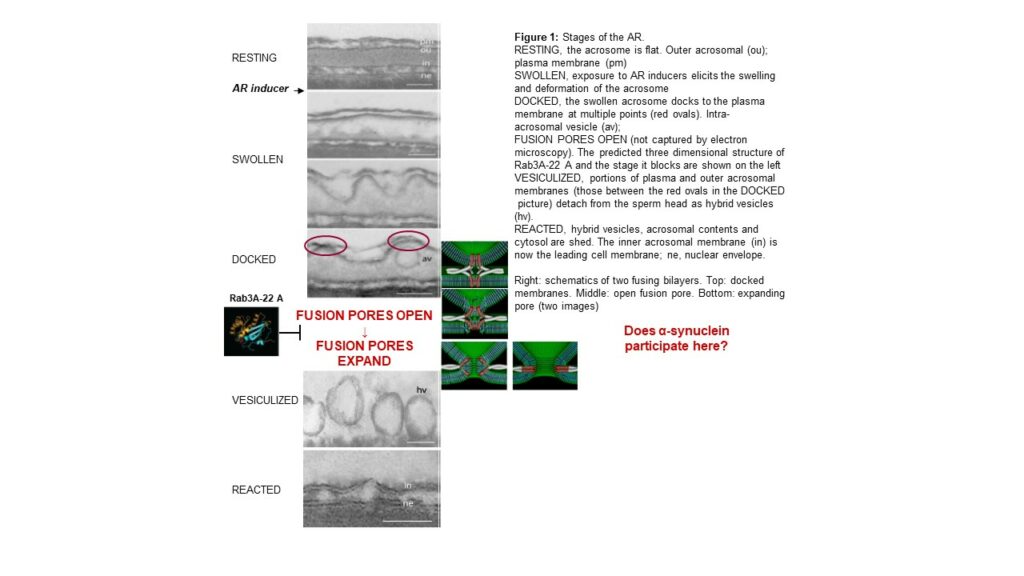
Aquí es donde mi laboratorio hace su aporte al campo de la exocitosis regulada porque el modelo secretorio con el que trabajamos, el espermatozoide humano, es muy favorable para estudios funcionales, morfológicos y bioquímicos. Nosotros estamos interesados en caracterizar la topología de la RA en espermatozoides humanos y en identificar las proteínas involucradas en la fusión de las membranas. Sin bien los reordenamientos estructurales que se producen en la cabeza de los espermatozoides durante la exocitosis acrosomal han sido investigados, todavía se desconocen los detalles del proceso de apertura y expansión de los poros de fusión y de cómo esta última etapa conduce a la formación de vesículas híbridas. Nuestros conocimientos sobre los cambios morfológicos que ocurren en la cabeza de los espermatozoides durante la exocitosis acrosomal son suministrados por las imágenes capturadas por microscopías y electrónica (principalmente de transmisión, Figura 1).
Los modelos bidimensionales no son los más adecuados para reflejar las reorganizaciones de la membrana que deben ocurrir durante la vesiculización y la expansión de los poros. Para ello, es necesario incorporar una tercera dimensión espacial a los modelos y aplicar principios topológicos (Figura 3).
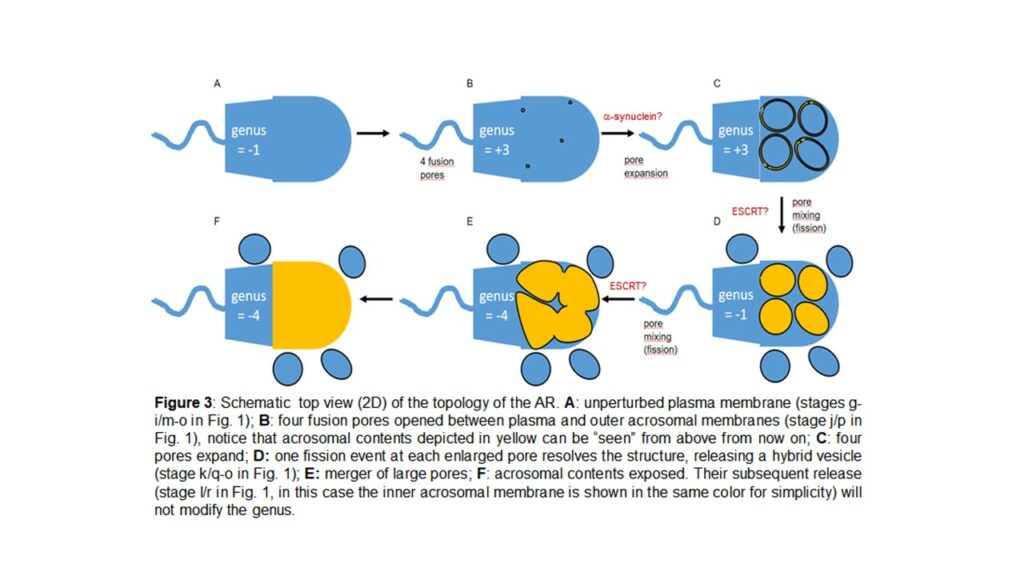
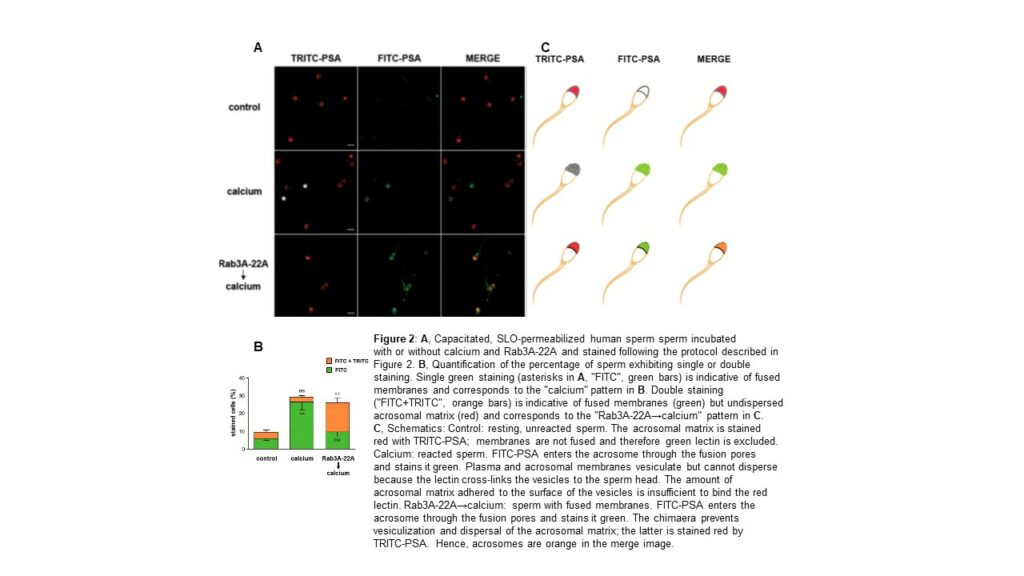
Para nuestra sorpresa, los cambios en el “parámetro topológico genus” revelaron que la exocitosis del acrosoma implica tanto la fusión como la fisión de las membranas. Para identificar moléculas clave, desentrañar las vías de transducción de señales y la interrelación entre ellas, analizar la apertura y expansión de los poros de fusión, etc, desarrollamos/aplicamos nuevas técnicas y herramientas. Estas incluyen la producción de proteínas quiméricas, como la compuesta por el dominio amino terminal de Rab3A y el carboxilo terminal de Rab22A (Figuras 1 y 2), proteínas fusionadas a péptidos permeables que les permiten transducirse al interior de los espermatozoides, como por ejemplo la propia quimera (líneas 1 y 3), α-sinucleína (línea 2), la subunidad catalítica de la toxina botulínica B (línea 3), miembros del complejo ESCRT (línea 4), la aplicación de sondas fluorescentes y microscopía (Figura 2A, todas las líneas).
Líneas de investigación
Línea de investigación 1: Apertura y expansión de poros de fusión
La reacción acrosomal (RA) involucra grandes cambios en la topología de la cabeza del espermatozoide: el acrosoma se hincha, la membrana acrosomal externa se curva hasta contactar la membrana plasmática, poros de fusión se abren en las zonas de contacto y se expanden hasta que eventualmente las dos membranas se vesiculizan y eliminan (Figura 1, micrografías electrónicas). Rab3 se activa (intercambia GDP por GTP) en una etapa temprana de la exocitosis espermática y posteriormente se inactiva (hidroliza el GTP unido) durante una etapa tardía. Si a Rab3 se le impide hidrolizar GTP, la exocitosis se detiene después de la fusión de las membranas pero antes de la expansión de los poros y vesiculización (ilustrado en la Figura 2 con Rab3A-22A, resultado igual con Rab3A-GTP-g-S). Estudiar los mecanismos moleculares que gobiernan la expansión de los poros de fusión es de interés primordial en mi laboratorio. Colaboración con el equipo del Dr. Diego Masone, quienes realizan los abordajes computacionales relacionados a esta línea y con la Dra. Victoria Berberián, que realiza los estudios que involucran microscopía electrónica.
Línea de investigación 2: Mecanismos moleculares involucrados en la regulación de la reacción acrosomal de espermatozoides humanos por alfa-sinucleína
α-sinucleína es una pequeña proteína acídica que contiene tres dominios modulares: una hélice que une lípidos en el amino terminal, una porción de unión a amiloide y una cola acídica en el carboxilo terminal. La molécula está desordenada en solución pero adopta una estructura de α-hélice cuando se une a vesículas ricas en fosfolípidos. Se le han atribuido diversos roles en la exocitosis que incluyen regular el número de vesículas secretorias en el pool de reserva, su tráfico a los sitios de liberación, su anclado a la membrana plasmática, la alteración de la sensibilidad de la exocitosis al calcio, efectos directos sobre la fusión, etc.
La α-sinucleína es una proteína pequeña involucrada en múltiples eventos de tráfico. De particular relevancia para mi laboratorio fue el hallazgo de que α-sinucleína regula la estabilidad del poro de fusión. α-sinucleína interactúa con componentes fundamentales de la maquinaria de fusión tales como Rab3 y miembros de la familia SNARE. Al interactuar con Rab3A-GTP, la α-sinucleína se recluta a membranas y modifica su curvatura. En esta línea investigamos el papel de α-sinucleína en la RA del espermatozoide humano, una exocitosis regulada que requiere Rab3A y procede a través de rearreglos de membranas dramáticos. La RA constituye un modelo ideal para estudiar poros de fusión porque es un evento único y catastrófico (ver Figuras 1 y 2). Colaboración con el equipo del Dr. Diego Masone, quienes realizan los abordajes computacionales relacionados a esta línea y con la Dra. Victoria Berberián, que realiza los estudios que involucran microscopía electrónica.
Línea de investigación 3: Transducción de proteínas permeables al espermatozoide humano
Hemos diseñado un plásmido (ver mapa en Luccesi et al, 2016) para expresar en Escherichia coli proteínas de interés fusionadas a un His6 tag y al péptido TAT del virus del HIV. Esta línea incluye la aplicación de His6-TAT-BoNT/B (cadena liviana de la toxina botulínica B), His6-TAT-Rab3A-Rab22A y His6-TAT-a-sinucleína, al estudio de distintos eventos relevantes para la fisiología espermática.
Línea de investigación 4: Laboratorio de Bioquímica Evolutiva
Las enzimas son cruciales para los organismos ya que permiten que todas las reacciones requeridas para el establecimiento y mantenimiento de la vida ocurran en tiempos compatibles con la misma. Nuestro enfoque de esLas enzimas son cruciales para los organismos ya que permiten que todas las reacciones requeridas para el establecimiento y mantenimiento de la vida ocurran en tiempos compatibles con la misma. Nuestro enfoque de estudio es la bioquímica evolutiva. Esta aproximación consiste en el análisis de la evolución de familias de proteínas para realizar inferencias acerca de la funcionalidad de sus ancestros, combinando filogenia molecular, bioinformática y la caracterización experimental de proteínas/enzimas, asistida por la síntesis de genes in vitro. El objetivo general de esta propuesta es comprender cómo surgen nuevas enzimas y cuáles son los caminos evolutivos que llevan a la emergencia de una actividad enzimática, así como los mecanismos moleculares implicados.