Mayorga, Luis

LABORATORIO DE TRANSPORTE INTRACELULAR
El laboratorio se interesa en los mecanismos de transporte intracelular en distintos modelos con un abordaje experimental y de modelización matemática. Una característica de nuestro trabajo ha sido el diseño de nuevos ensayos para abordar los fenómenos bajo estudio de un modo no explorado anteriormente. Nuestro interés en nuevas metodología ha hecho que se incorporen investigadores con enfoques diferentes con sus propias líneas de investigación.
Líneas de investigación
I. Combinación de modelización basada en agentes (ABM) con ecuaciones diferenciales (ODE) para generar simulaciones de procesos de transporte intracelular complejos
En esta línea de trabajo hemos desarrollado una plataforma computacional utilizando la combinación de modelización basada en agentes con ecuaciones diferenciales para simular transporte intracelular en las vías endocítica y exocítica. Esta plataforma permite simular la naturaleza dinámica de las estructuras intracelulares que se mueven, cambian de forma, interaccionan, se fusionan y dividen y al mismo tiempo son base de una compleja red de interacciones moleculares y reacciones químicas.
Utilizando este modelo hemos reproducido aspectos cinéticos y funcionales de la presentación cruzada en células dendríticas. Hemos avanzado además en la modelización del transporte de Glut4 en células musculares en condiciones de reposo y luego de la estimulación con insulina.
Nuestra expectativa es que la plataforma y los modelos generados sean útiles para otros biólogos celulares trabajando en transporte intracelular y en otros campos de la Biología Celular.

II. Estudio de proteínas involucradas en la exocitosis de GLUT4 en células mioblásticas (Martín Pavarotti)
La captación de glucosa en tejido muscular y adiposo está mediada por el transportador de glucosa GLUT4. El aumento de insulina plasmática y la contracción muscular disparan el transporte y fusión de vesículas ricas en GLUT4 con membrana plasmática generando un incremento de GLUT4 sobre la superficie celular y un consecuente ingreso de glucosa a las células. La resistencia a la insulina podría deberse en parte a problemas en el tráfico y fusión con la membrana plasmática de vesículas transportadoras de GLUT4.
Nuestro objetivo principal es estudiar nuevos integrantes moleculares capaces de modular la exocitosis de GLUT4 tanto en situaciones controles como en la insulino resistencia. Para ello, estudiamos la translocación de GLUT4 e ingreso de glucosa en células mioblásticas modificadas por el silenciamiento de genes, sobreexpresión de proteínas y uso de proteínas permeables.
Un ejemplo claro es el caso de Complexina-2. Recientemente hemos demostrado la presencia de complexina-2 en células musculares y tejido muscular.

Complexina ha sido ampliamente estudiada en tejido nerviosos, páncreas y sistema neuroendocrino, en donde participa en los procesos de exositosis. Los experimentos de exocitosis de GLUT4 inducidos por insulina en células knock-down para complexina-2 muestran su participación en dicho evento.
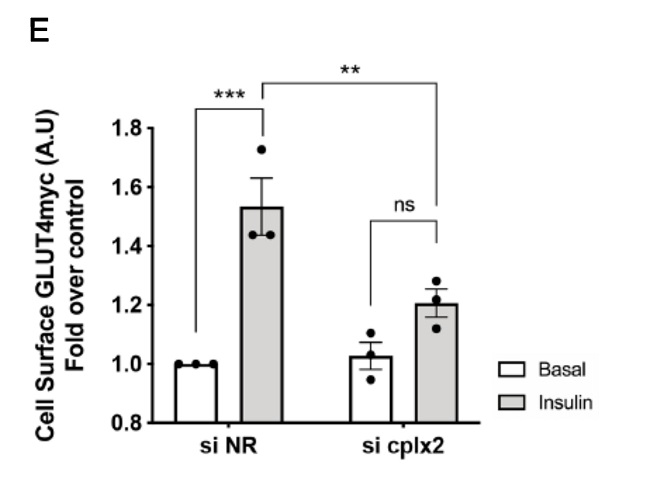
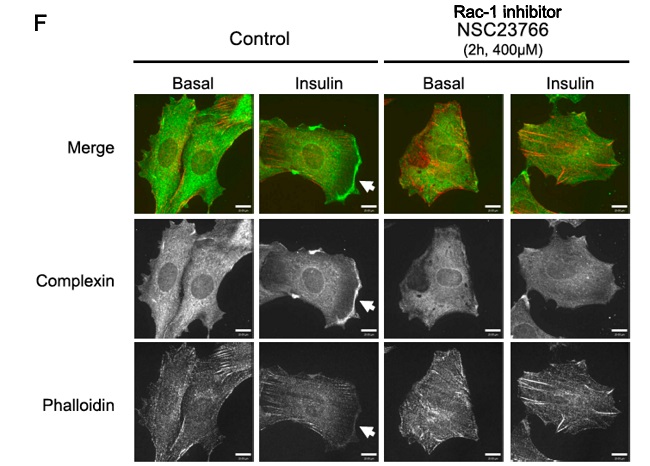
Por otro lado, los estudios de localización muestran su translocación a membrana plasmática en presencia de insulina, siendo este evento dependiente de la GTPasa Rac-1.
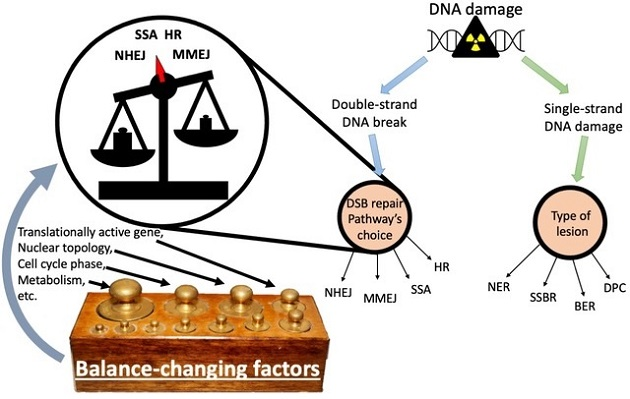
III. Reparación de daños en el ADN y su regulación (Luis Mariano Polo)
Las vías de reparación de ADN dañado son la principal salvaguarda de la información contenida en el genoma de las células. Los errores en estos sistemas generan alteraciones que van desde mutaciones silenciosas hasta la pérdida de grandes cantidades de material genético, que puede causar enfermedades como el cáncer en humanos. Además, los nuevos avances en las tecnologías de edición por medio de tijeras moleculares se valen de esos mismos sistemas de reparación de ADN. Por eso, comprender su funcionamiento y regulación nos permite, por un lado, dar lugar a terapias para tratar enfermedades (principalmente cáncer, pero también otras como enfermedades neurológicas, infecciones virales y bacterianas), y, por el otro, manipular su balance para aumentar las probabilidades de éxito al editar el genoma.
Usando técnicas de biología celular, molecular junto con bioquímica y biología estructural, trabajamos para desentrañar los mecanismos de salvaguarda del genoma de las células humanas y su regulación.
IV. Estudios funcionales y mecanísticos de la translocación de proteínas y nanopartículas recubiertas con péptidos de penetración celular a través de membranas celulares
La membrana celular es una barrera semipermeable eficaz esencial para la supervivencia y la función celular. Sin embargo, también es un obstáculo importante para el suministro intracelular de moléculas para el diagnóstico y tratamiento de situaciones patológicas. Por lo tanto, el desarrollo de herramientas que faciliten la captación celular de macromoléculas para la investigación básica y las aplicaciones biomédicas constituye todo un campo de estudio en la actualidad. En los últimos años los péptidos de penetración celular (CPPs) han atraído considerable atención por su potencial como herramientas en el diseño de sistemas de suministro de fármacos, dada su capacidad de penetrar rápida y espontáneamente la membrana celular y de internalizar nanopartículas (NPs) y macromoléculas de alto peso molecular.Por lo tanto, la posibilidad de introducir de modo directo una macromolécula abre importantes posibilidades, sobre todo para células que no poseen la capacidad de transcribir y traducir, como el espermatozoide, o que son muy difíciles de transfectar por los métodos tradicionales, como las células dendríticas o los ovocitos.
En base a esto, y usando una combinación de técnicas de biología celular, biofísicas, síntesis orgánica, microscopia electrónica, confocal y simulaciones computacionales, nos concentramos en: 1) la síntesis, caracterización y empleo de nanopartículas de interés biológico o biomédico: NPs de oro, de sílice porosa y de poli (ácido láctico-co-glicólico); 2) el estudio de las interacciones de nanopartículas con membranas modelo y membranas celulares in-vivo; 3) el estudio, funcional y mecanístico, de los CPPs solos y unidos a proteínas o nanopartículas en varios tipos celulares (espermatozoides, dendríticas, ovocitos, fibroblasto, etc).
