Fader Kaiser, Claudio
LABORATORIO DE FISIOLOGÍA Y FISIOPATOLOGÍA DEL GLÓBULO ROJO
Líneas de investigación
Nuestro grupo estudia los mecanismos celulares y moleculares que participan en el proceso de maduración del glóbulo rojo (Eritropoyesis), como también las alteraciones en dicho mecanismo. Situaciones que alteren el proceso normal de eritropoyesis pueden conducir a condiciones de sobreproducción de células hematopoyéticas (como en el caso de algunas leucemias), o a una producción deficiente de las mismas (como en la anemia aplásica). La autofagia ha sido asociada a la diferenciación y maduración de algunos tipos celulares (glóbulos rojos), como también a ciertos mecanismos implicados en la resistencia al tratamiento quimioterápico de determinados tipos de leucemias. Es así, que nuestro grupo trabaja con énfasis en el estudio de blancos moleculares que modulen los niveles autofágicos, los cuales constituyen una posible alternativa para el desarrollo de nuevas estrategias terapéuticas que nos ayuden a luchar contra patologías que afecten la normal diferenciación y maduración de las células hematopoyéticas, como es el caso de las leucemias y el posible tratamiento de los pacientes que desarrollan farmacoresistencia.
I. Estudio celular y molecular de la autofagia durante la eritropoyesis humana.
La eritropoyesis es un proceso complejo y finamente regulado, el cual permite la producción de alrededor de 2 millones de glóbulos rojos por segundo, en los adultos sanos. Es importante tener en cuenta que durante este proceso los precursores de los glóbulos rojos (GR) sufren una extensiva remodelación de sus membranas, disminución del volumen celular, producción de proteínas específicas (hemoglobina) y eliminación de organelas membranosas (mitocondrias y ribosomas), lo cual asegura la función celular crítica del GR. En muchos de estos procesos, la autofagia tiene un papel importante, principalmente en la eliminación de las organelas.
Nuestro grupo de trabajo ha estudiado en profundidad la maquinaria molecular, implicada en el tráfico intracelular, requerida para la maduración del autofagosoma. De forma interesante, hemos demostrado que hemina (un inductor fisiológico de la eritropoyesis) induce la mitofagia, un proceso de autofagia especializado en el secuestro y degradación de mitocondrias. Así mismo, hemina genera un aumento de la expresión y la síntesis de algunas proteínas autofágicas, tales como LC3, Beclina 1 y Atg 5, favoreciendo la maduración de dichas células. Además, hemos podido demostrar que la proteína mitocondrial NIX es fundamental para inducción de este proceso autofágico (Figura 1).
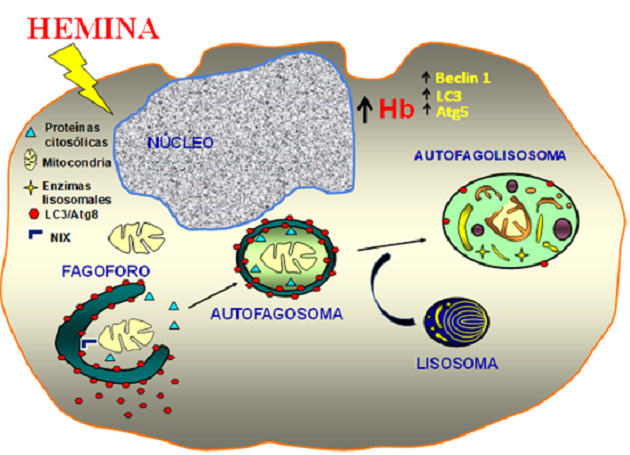 Figura 1: Hemina (un inductor de la maduración eritroide) puede estimular la expresión de genes autofágicos críticos ( Map1a1b (LC3), BECN1, Atg5) y conduce a la mitofagia de manera dependiente de NIX. Nuestros resultados sugieren que la hemina favorece la maduración eritroide al generar una respuesta autofágica en las células K562. (Fuente: Fader CM, Biology of the Cell 2016)
Figura 1: Hemina (un inductor de la maduración eritroide) puede estimular la expresión de genes autofágicos críticos ( Map1a1b (LC3), BECN1, Atg5) y conduce a la mitofagia de manera dependiente de NIX. Nuestros resultados sugieren que la hemina favorece la maduración eritroide al generar una respuesta autofágica en las células K562. (Fuente: Fader CM, Biology of the Cell 2016)
LRP1 (proteína 1 relacionada con el receptor de lipoproteína de baja densidad), es un receptor de membrana plasmática, el cual está involucrado en muchos procesos celulares tales como el metabolísmo de alfa-2-macroglobulina y de la apolipoproteína E, migración celular, eliminación del complejo hemina-hemopexina, apoptosis y autofagia. En nuestro laboratorio, demostramos que el tratamiento con hemina, de células con características eritroblásticas, induce la vía autofágica de manera dependiente de LRP1, siendo inhibido este proceso intracelular al depletar las células de dicho receptor (knockdown). Estos datos ponen de manifiesto la importancia de determinar los niveles de LRP1, como así también su función en las distintas etapas de la eritropoyesis (Figura 2).
Es por ello, que el estudio en profundidad de los mecanismos moleculares y celulares que regulan la autofagia y la actividad del receptor LRP1, otorgará un valioso conocimiento para el entendimiento, no solo de la fisiología del proceso de maduración eritroide, sino también del tratamiento de aquellas hematopatologías asociadas a este proceso.
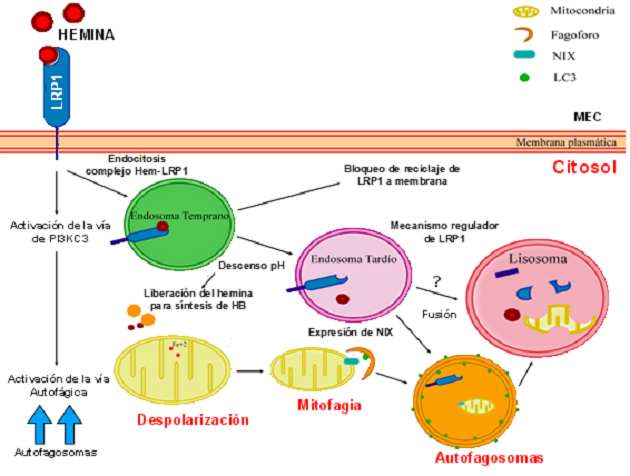
Figura 2: Hemina ingresa a las células eritroides a través de LRP1, activando las vías de señalización que regulan la respuesta autofágica (mitofagia). Por otro lado, hemina induce la incorporación de LRP1 en la vía autofágica y su ulterior degradación en lisosomas. (Fuente: Grosso RA, Bioscience Reports 2018)
II. Estudio del rol de la autofagia en la resistencia de células eritroleucémicas a la quimioterapia
La leucemia es un grupo heterogéneo de enfermedades caracterizado, en algunos casos, por una proliferación descontrolada de un linaje específico de precursores hematopoyéticos, en detrimento de otros, pudiendo producir anemia, neutropenia y trombocitopenia. Las leucemias representan una causa importante de mortalidad y morbilidad en la población Mundial. En la actualidad, esta enfermedad es un serio problema para la salud de la población mundial y también para la población argentina. El impacto económico para un individuo y su familia es realmente dramático debido a lo extenso de su tratamiento y al costo del mismo, siendo incluso muy difícil de afrontar para los sistemas de salud pública.
En el cáncer, la autofagia tiene una función dual ya que actúa como supresor tumoral en células no tumorales o en tiempos tempranos de tumorigénesis, pero también resulta crucial en la supervivencia de las células tumorales cuando el tumor se ha establecido favoreciendo la transformación maligna de la célula y la progresión del cáncer. Además, la autofagia juega un papel importante como mecanismo celular que media la sensibilización/resistencia a la quimioterapia.
Como mencionamos anteriormente, LRP1 participa en la modulación de la autofagia en células eritroleucémicas. Nuestro laboratorio, se encuentra estudiando en profundidad los mecanismos moleculares y celulares que regulan la autofagia y la actividad del receptor LRP1, en el contexto de la célula tumoral. Esto otorgará un valioso conocimiento para el entendimiento del tratamiento quimioterápico en la LMC, en donde la modulación de la autofagia (inhibición) constituiría una alternativa útil para el tratamiento de los pacientes que desarrollan farmacorresistencia.
III. Mecanismos de la secreción plaquetaria y su efecto en la regeneración tisular en un modelo de enfermedad periodontal
Investigamos los mecanismos de secreción plaquetaria in vitro y evaluamos su capacidad de diferenciar células mesenquimales, así como la capacidad regenerativa del plasma rico en plaquetas (PRP) en un modelo animal de enfermedad periodontal, una enfermedad inflamatoria que afecta el aparato de soporte dental y tiene un impacto significativo en la salud bucal y general de los pacientes.
La secreción plaquetaria es un proceso fisiológico que implica la liberación de contenido celular cuando las plaquetas son activadas. Las plaquetas contienen gránulos específicos con características diferentes entre ellos, y desempeñan roles claves en la activación plaquetaria y la respuesta a la lesión.
La secreción plaquetaria desempeña un papel crucial en la coagulación, la reparación de heridas, la inflamación y la angiogénesis. El PRP también ha demostrado promover la diferenciación osteogénica de las células madre derivadas de tejido adiposo humano, lo que sugiere su potencial para el tratamiento de defectos óseos alveolares.
