Romano, Patricia Silvia

LABORATORIO DE BIOLOGÍA DE TRYPANOSOMA CRUZI Y LA CÉLULA HOSPEDADORA
Nuestro grupo estudia los mecanismos celulares y moleculares que participan en el ciclo biológico de Trypanosoma cruzi, el agente causal de la enfermedad de Chagas, una patología endémica en nuestro país y en América Latina, y cuyo tratamiento tiene escasa efectividad en la fase crónica de la infección. Enfocamos nuestras investigaciones en los procesos que regulan la diferenciación parasitaria y la infección en la célula hospedadora y en los seres humanos con énfasis en la búsqueda de posibles blancos terapéuticos que puedan ser utilizados contra el Chagas.
El laboratorio trabaja en cuatro líneas de investigación específicas.
Líneas de investigación:
I. Análisis del papel de las vías de transporte vesicular de la célula hospedadora durante la infección por T. cruzi en diferentes tipos de células, fagocitos profesionales y no profesionales
Investigamos el papel de proteínas que regulan el transporte vesicular en las vías endocítica, exocítica y autofágica (proteínas Rabs y SNAREs) en las distintas etapas de la infección por T. cruzi como se muestra en la siguiente figura.
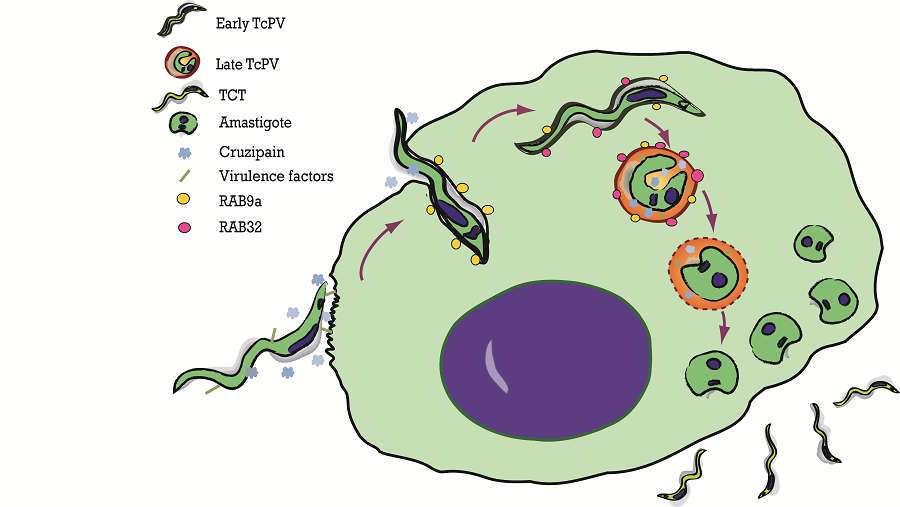
Previamente describimos que la autofagia participa en el proceso de invasión de T. cruzi en fagocitos no profesionales y que la vacuola parasitófora adquiere la proteína autofagosomal LC3 en etapas tempranas de la infección (Romano et al, 2009; Romano et al, 2010), mientras que las proteínas SNARE VAMP7 y sus “partners” VTi1b y SNAP23 regulan la etapa de maduración de la vacuola en concordancia con la llegada de lisosomas (Cueto et al, 2017).
Recientemente describimos las participación de las proteínas Rab endocíticas (Rab 5, Rab21, Rab22 y Rab7) y de Rab9 y Rab32 durante el transporte intracelular de la vacuola y su participación en el proceso global de infección (Salassa et al, 2020; Salassa et al, en prensa).
II. Estudio del rol de la autofagia en el transcurso de la infección por T. cruzi en ratones y de su función moduladora de la respuesta inmune.
Previamente demostramos que la deficiencia autofágica, en ratones genéticamente modificados (ratones “knock out” heterocigotas para la proteína autofágica Beclina-1), produce una infección más agresiva elevando los valores de parasitemia y parasitismo cardíaco, produciendo la muerte temprana de estos ratones (Casassa et al, 2019).
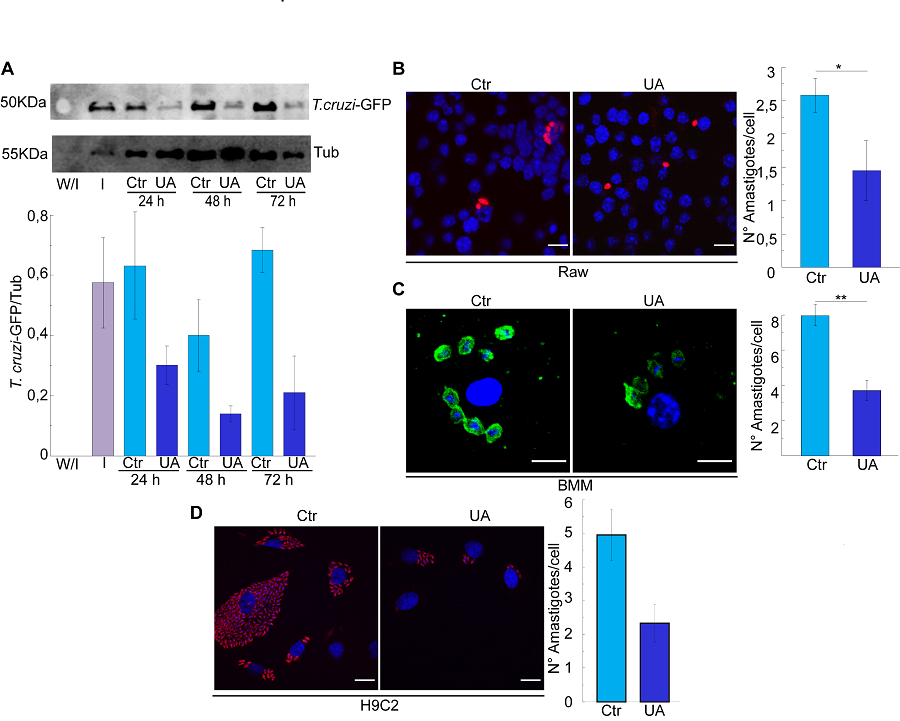
Recientemente demostramos que la inducción de la autofagia por Ácido Ursólico favorece la eliminación de amastigotes en los macrófagos infectados y en otros tipos celulares (Vanrell et al, 2022; ver figura) por lo que continuamos estudiando la participación de la autofagia en el desarollo de las respuestas inmunes innata y adaptativa que se activan durante la infección por T. cruzi.
III. Estudio del rol de factores de virulencia de T. cruzi en el ciclo biológico examinando principalmente la infección y diferenciación parasitaria
En nuestro laboratorio hemos caracterizado el funcionamiento de la vía autofágica de T. cruzi durante la diferenciación parasitaria que ocurre tanto en el insecto vector como en la célula humana. Por medio del uso de drogas específicas, hemos demostrado que la regulación de esta vía en T. cruzi presenta similitudes y diferencias con la regulación de la
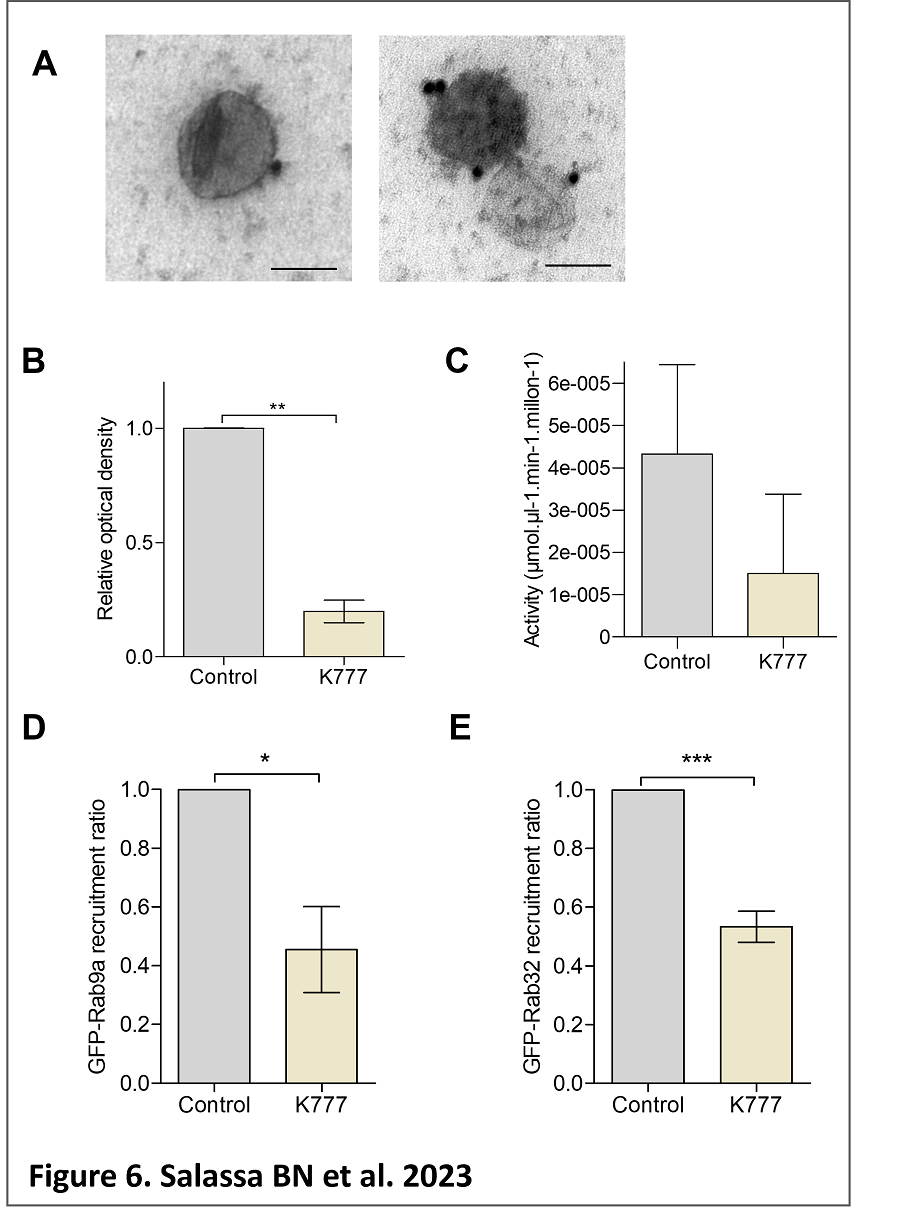
misma en las células de mamíferos siendo las diferencias un foco interesante de estudio en la búsqueda de posibles blancos terapéuticos (Vanrell et al, 2017). Además encontramos que la autofagia parasitaria regula la actividad de cruzipaína, uno de los principales factores de virulencia parasitarios (Losinno et al, 2021). De manera interesante, observamos que cruzipaína se halla en las vesículas extracelulares secretadas por T. cruzi durante la diferenciación de
tripomastigotes a amastigotes y que su inhibición reduce el reclutamiento de Rab9 y Rab32 a la vacuola parasitófora (Salassa et al, en prensa; ver figura) permitiendo postular que este factor parasitario es clave para que T. cruzi manipule a la célula con el fin de favorecer la infección. En la actualidad estamos estudiando la función de la cruzipaína y de la autofagia parasitaria en las distintas etapas de infección.
IV. Análisis del efecto de drogas que afectan el desarrollo de la infección por T. cruzi, con blancos en el parásito o en el hospedador y que puedan ser utilizadas para el tratamiento de la Enfermedad de Chagas
A partir de los datos obtenidos de la investigación básica, estudiamos el efecto de compuestos, naturales o sintéticos, que pueden inhibir blancos específicos en el parásito o en el hospedador afectando el desarrollo normal de la infección por T. cruzi, como en el caso del Ácido ursólico (ver figura 2). Una estrategia es usar drogas de reposicionamiento, es decir compuestos ya aprobados para su uso en otras patologías y que puedan ser utilizados para una nueva indicación considerando una dosis efectiva y terapéuticamente segura. Hemos encontrado que carvedilol, un compuesto ampliamente usado para el tratamiento de la hipertensión arterial, inhibe la autofagia parasitaria y reduce significativamente la infección (Rivero et al, 2021). Actualmente estamos analizando las dosis y regímenes terapéuticos de este compuesto tanto en modelos de infección in vitro como in vivo en ratones como una
nueva propuesta terapéutica para el tratamiento de la enfermedad de Chagas.
