Colombo, María Isabel

LABORATORIO MECANISMOS MOLECULARES IMPLICADOS EN EL TRÁFICO VESICULAR Y LA VÍA AUTOFÁGICA
Líneas de investigación
I. Transporte vesicular en la vía autofágica
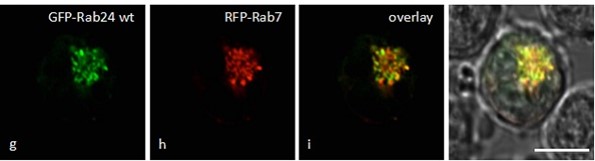
Nuestro grupo está interesado en el estudio, a nivel molecular de eventos del transporte intracelular mediado por vesículas. En particular, estudiamos la vía autofágica y su relación con las rutas endocítica y fagocítica. La autofagia es un proceso de reciclaje celular altamente regulado cuya función básica implica el secuestro de componentes citoplasmáticos para ser finalmente degradados por los lisosomas. Estamos interesados en determinar el mecanismo molecular implicado en pasos específicos del proceso de autofagia, como la formación del autofagosoma y la fusión con compartimentos de la vía endocítica (cuerpos multivesiculares y lisosomas), así como en eventos exocíticos de compartimentos relacionados con la autofagia. Estamos focalizados en la identificación de las moléculas que controlan estos eventos de transporte, estudiando específicamente la participación de Rabs y SNARES y sus proteínas asociadas, proteínas clave de la maquinaria molecular implicada en el transporte vesicular.
II. Relación entre microorganismos intracelulares patógenos y la vía autofágica
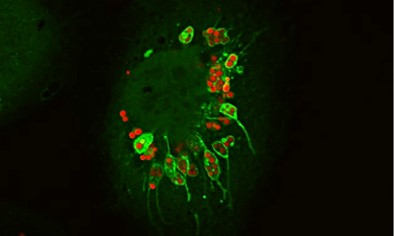
Nuestro objetivo es explorar la modulación de la maquinaria de transporte por microorganismos que alteran la vía fagocítica y autofágica como estrategia de supervivencia. Nuestro grupo estudia varios patógenos intracelulares como Mycobacterium tuberculosis, M. marinum, M. smegmatis y Staphylococcus aureus, que sobreviven en la célula hospedadora utilizando diferentes estrategias de supervivencia intracelular. Varios de estos microorganismos interceptan la vía autofágica y para ciertas bacterias intracelulares la autofagia actúa como un mecanismo de defensa (“xenofagia”). Por el contrario, otros microorganismos subvierten la vía autofágica para su propio beneficio. Nuestro propósito es entender estos mecanismos a nivel molecular para desarrollar nuevas estrategias terapéuticas que nos ayuden a luchar contra estos patógenos intracelulares.
III. Pez cebra como modelo de infecciones por patógenos y autofagia
El pez cebra (Danio rerio) es un organismo-modelo que hemos incorporado en nuestro instituto dada la amplia versatilidad que ofrece y que contribuye a su utilidad: la facilidad de obtener un gran número de embriones, su accesibilidad debido al desarrollo externo, la transparencia óptica de las etapas embrionarias y las larvas, la posibilidad de aplicar una amplia gama de herramientas genéticas, disponibilidad de mutantes y una gran variedad en colecciones de líneas con reporteros transgénicos. La finalidad de la incorporación de este modelo es utilizarlo para el estudio de diferentes procesos que involucran la vía autofágica, con énfasis en procesos infectivos. Dentro de las líneas se encuentran:
• Desarrollo del modelo de pez cebra para el estudio de nuevos tratamientos en la infección por Staphylococcus aureus. Debido a antecedentes donde se demuestra que la vía autofágica es importante para el proceso infeccioso de S. aureus es que hemos decidido combinar el conocimiento existente de esta vía en nuestro laboratorio con las posibilidades que ofrece el modelo de pez cebra para estudiar nuevas estrategias terapéuticas a partir de la manipulaión de la vía autofágica.
• Evaluación de la función de la vía autofágica durante la respuesta inmune innata a la tuberculosis utilizando como huésped-patógeno sustituto Pez Cebra-Mycobacterium marinum. Mycobacterium tuberculosis (Mtb) es un patógeno intracelular facultativo que coloniza y se multiplica en los macrófagos del huésped. M. marinum (Mm) es un pariente cercano de Mtb que causa una enfermedad similar a la tuberculosis en peces y que se utiliza ampliamente como un modelo alternativo para estudiar micobacterias. Nos proponemos utilizar como modelo para el estudio de la tuberculosis la infección del pez cebra con Mm y analizar el papel de la vía autofágica durante la respuesta inmune innata y adaptativa a la infección por las micobacterias in vivo.
