Fisiopatología Ovárica

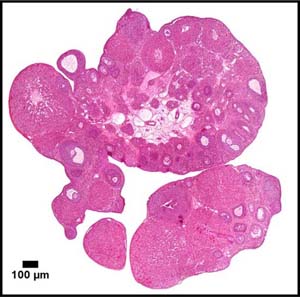
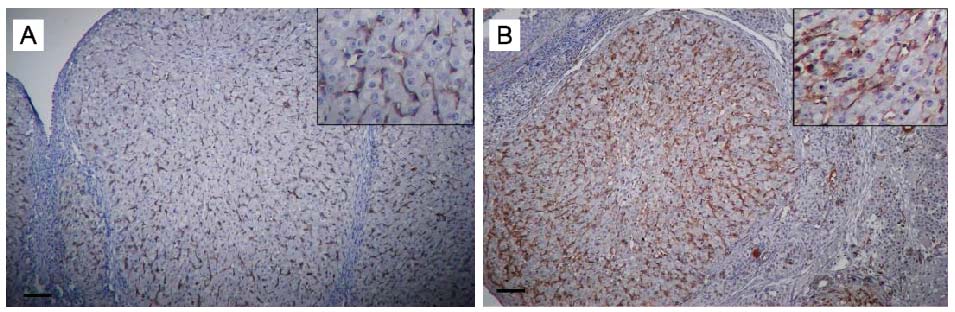
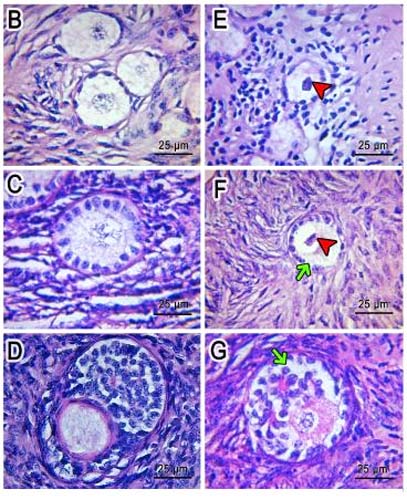
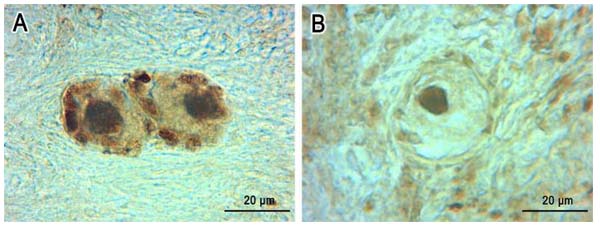
En nuestro laboratorio tenemos como objetivo el estudio de los mecanismos fisiológicos y fisiopatológicos responsables del desarrollo del ovario en diversos modelos experimentales (murinos, bovinos y humanos). Analizamos particularmente las acciones de ciertos neuroesteroides sobre el funcionamiento del folículo y del cuerpo lúteo ovárico con el fin de dilucidar si estas sustancias pueden ser propuestas como marcadores de patologías en el ovario (ovario poliquístico, cáncer de ovario, etc). El folículo ovárico contiene el ovocito y células foliculares responsables de la producción de las hormonas sexuales femeninas, estradiol y progesterona. También analizamos la funcionalidad del cuerpo lúteo que libera progesterona, hormona fundamental para la funcionalidad del útero y la implantación de los embriones.
Estudiamos también los efectos de los neuroesteroides y de otros factores que pueden afectar la viabilidad, angiogénesis, apoptosis y proliferación de células foliculares y del ovocito. Recientemente hemos iniciado una nueva línea de investigación sobre los efectos del estrés térmico sobre la reserva ovárica en bovinos del desierto.
Además, investigamos las acciones de ciertos derivados de la progesterona en la progresión del cáncer de ovario mediante cultivo celular de líneas derivadas de cáncer de ovario, con el fin de dilucidar algún marcador predictivo de este proceso y/o encontrar nuevos tratamientos para combatir este padecimiento.
Aportamos con nuestros estudios al conocimiento de nuevas alternativas de diagnóstico y tratamiento de enfermedades ligadas al ovario. Contamos con una extensa red de laboratorios asociados, equipos médicos y veterinarios con los que colaboramos tanto del ámbito público como privado de modo de acercar los hallazgos de mesada de nuestro laboratorio directo a la práctica médica /veterinaria (medicina traslacional) al servicio de las poblaciones.

Para más información contactarse con la Dra. Myriam Laconi, mlaconi@mendoza-conicet.gob.ar