Líneas de Investigación
-
Rol de la terapia dirigida contra PARP en células tumorales: Potencial herramienta en la optimización del tratamiento en cáncer de mama.
Dra. Laura María Vargas Roig – Dra. Mayra Lis SottileEl cáncer de mama (CM) es una enfermedad de elevada incidencia en Argentina siendo la primera causa de muerte por tumores en mujeres (16 muertes por día) en nuestro país. Actualmente, los inhibidores de la enzima poli(ADP-ribosa) polimerasa (PARP), como el olaparib, conforman una de las estrategias más prometedoras para el tratamiento de esta enfermedad. Si bien el olaparib fue propuesto para el tratamiento del CM con mutaciones germinales en genes BRCA, tumores de mama esporádicos que presentan deficiencias en otras proteínas de reparación del ADN, también podrían beneficiarse de esta terapia. Esto se debe en parte, a que aún quedan por definir vías de reparación diferentes a la Recombinación Homóloga que podrían participar en la respuesta al daño del ADN inducido por olaparib. En nuestro laboratorio, nos dedicamos a investigar nuevas estrategias terapéuticas que combinen el uso de olaparib con drogas convencionales en CM como la doxorrubicina. En este contexto, nos proponemos obtener las bases moleculares responsables del efecto resultante de la administración simultánea de olaparib y doxorrubicina en líneas celulares tumorales mamarias. Consideramos que olaparib podría ser una buena herramienta para optimizar la terapia basada en doxorrubicina. La combinación de ambos tratamientos podría constituir una estrategia para reducir los efectos no deseados de la quimioterapia, sin pérdida de la acción antitumoral y finalmente, mejorar la calidad de vida de los pacientes.
- Evaluación de la eficacia de la reparación de rupturas de doble cadena en el ADN, como nuevo abordaje para la prevención y diagnóstico del cáncer de mama en familias de alto riesgo
Dra. Laura Vargas Roig – Dra. Silvina Nadin-Dra. Mariel Fanelli
Objetivo general: Identificación de las pacientes con criterios clínicos de CMH, sin mutaciones germinales en genes de alta susceptibilidad para la enfermedad, que tienen deficiencia en la reparación de RDC en el ADN. La hipótesis planteada es que la deficiencia del mecanismo de RH es un parámetro útil para categorizar el riesgo de desarrollar CM en pacientes con criterios clínicos de CMH no portadoras de mutaciones germinales en los genes de susceptibilidad conocidos. Objetivos específicos. OBJETIVO 1: Determinar el daño y la capacidad de reparación de RDC en el ADN inducidas por RI en LSP de pacientes con criterios clínicos de CMH, no portadoras de mutaciones germinales en los genes de susceptibilidad para CM. OBJETIVO 2: Evaluar marcadores de daño y de la vía de reparación por RH del ADN en sangre periférica de pacientes con criterios clínicos de CMH, no portadoras de mutaciones germinales en los genes de susceptibilidad para CM. OBJETIVO 3: Analizar la expresión de componentes del mecanismo de reparación por RH en el tejido tumoral de pacientes con criterios clínicos de CMH, no portadoras de mutaciones en los genes de susceptibilidad para CM, y correlacionarla con parámetros clínico-patológicos. OBJETIVO 4: Determinar miARNs que interfieren en la vía de RH en el tejido tumoral y sangre periférica de pacientes con criterios clínicos de CMH, no portadoras de mutaciones en los genes de susceptibilidad para CM, y correlacionarlos con parámetros clínico-patológicos. Para desarrollar los objetivos planteados utilizaremos LSP y tumores mamarios. El daño y reparación del ADN se estudiarán mediante micronúcleos, ensayo cometa alcalino e inmunofluorescencia para γH2AX, 53BP1 y RAD51. Se analizarán por inmunohistoquímica componentes de la vía de RH: BRCA1, BRCA2, PALPB2, ATM y CHK2. La expresión de miARNs se realizará por PCR en tiempo real. Nuestros resultados serán de utilidad para implementar estrategias de prevención, diagnóstico y seguimiento personalizado de pacientes con CM que no son portadoras de mutaciones germinales en los genes de alta susceptibilidad como BRCA1/2 pero tienen deficiencias en el mecanismo de RH.
- Proteínas de golpe de calor y vías de señalización y reparación del daño al ADN en la respuesta tumoral a agentes antineoplásicos.
Dra. Silvina Beatriz Nadin – Dra. Niubys Cayado Gutiérrez-Dra. Laura Vargas Roig
-Rol de Hsp27 en la señalización y reparación de daños al ADN inducidos por agentes antineoplásicos en líneas celulares tumorales.
-Estudio de proteínas de reparación y sensores de daño al ADN como biomarcadores predictivos/pronósticos en pacientes oncológicos tratados con drogas antineoplásicas análogas del platino.
Dado que una gran mayoría de las drogas antitumorales empleadas en quimioterapia poseen como blanco citotóxico a la molécula de ADN, resulta crucial profundizar el conocimiento de las interacciones y funciones de las proteínas involucradas en el desarrollo de resistencia. Diferentes mecanismos moleculares se han vinculado con la resistencia a drogas, entre ellos, la sobre-expresión de proteínas de golpe de calor (Heat Shock Proteins, HSPs) o alteraciones en mecanismos de reparación del ADN, tales como las deficiencias en el sistema Mismatch Repair (MMR). Las HSPs desempeñan importantes funciones celulares, no sólo como chaperonas asistiendo la síntesis o plegamiento de proteínas, sino también inhibiendo la apoptosis. Las HSPs también se han vinculado con diferentes vías de reparación del ADN, incrementando su actividad. Nuestro grupo ha demostrado la colocalización e interacción entre Hsp27 (HSPB1) y Hsp72 (HSPA1A) con las proteínas componentes del sistema de reparación Mismatch Repair, MLH1 y MSH2, en células tumorales de colon humanas en respuesta al tratamiento con cisplatino.
Además, nuestro grupo de investigación reportó la utilidad de la proteína Hsp70 como marcador pronóstico en pacientes con cáncer de mama tratadas con monoquimioterapia neoadyuvante con antraciclinas, su expresión nuclear es indicador de la necesidad de un cambio en el esquema terapéutico para evitar la resistencia a la quimioterapia [Nadin S.B., Sottile M.L., Montt Guevara M.M., Gauna G., Daguerre P., Leuzzi M., Gago F.E., Ibarra J., Cuello-Carrión F.D., Ciocca D.R., Vargas Roig L.M. Prognostic implication of HSPA (HSP70) in breast cancer patients treated with neoadjuvant anthracycline based chemotherapy. Cell Stress Chaperones 19 (2014) 493-505].
Recientemente reportamos la utilidad predictiva y pronóstica en cáncer del estudio de la forma fosforilada de la proteína Hsp90α en tumores primarios [Sottile ML, Cuello-Carrión FD, Gómez LC, Semino S, Ibarra J, García MB, Gonzalez L, Vargas-Roig LM, Nadin SB. DNA Damage Repair Proteins, HSP27, and Phosphorylated-HSP90α as Predictive/Prognostic Biomarkers of Platinum-based Cancer Chemotherapy: An Exploratory Study. Appl Immunohistochem Mol Morphol. 2022 Jul 1;30(6):425-434. doi: 10.1097/PAI.0000000000001037].
En los últimos años, el descubrimiento de proteínas clientes de las HSPs ha permitido el desarrollo de inhibidores proteicos, los que, combinados con terapias convencionales, han resultado sumamente promisorios en ensayos clínicos. En consecuencia, el futuro de las HSPs como blancos terapéuticos dependerá de la función que cumplan según el contexto celular.
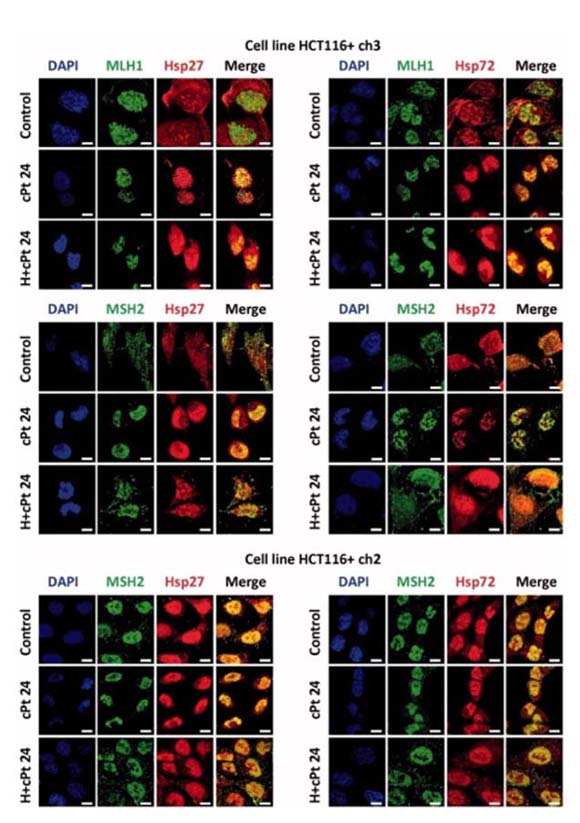
MLH1 and MSH2 colocalise with Hsp27 and Hsp72 in HCT116+ch3 (MMR+) and HCT116+ch2 (MMR−) cells. Tumour cells were double-stained with MLH1 or MSH2 (green) and Hsp27 or Hsp72 (red) antibodies. Colocalisation was revealed by the signals overlap (yellow) in the merged images. A scale bar was included in each microphotograph (20 μm). Control, untreated cells; cPt 24, cells collected 24 h after 10 μM cPt exposure. H+cPt 24, cells treated with cPt 24 h after H, and collected 24 h later. (Sottile ML, Losinno AD, Fanelli MA, Cuello-Carrión FD, Montt-Guevara MM, Vargas-Roig LM, Nadin SB. Hyperthermia effects on Hsp27 and Hsp72 associations with mismatch repair (MMR) proteins and cisplatin toxicity in MMR-deficient/proficient colon cancer cell lines. Int J Hyperthermia. 2015;31(5):464-75.)
- Vías de señalización en la migración de células tumorales mamarias.
Dra. Marina Inés Flamini – Lic. Ana Carla Castro Guijarro
El cáncer de mama (CM) es la neoplasia maligna más frecuente en mujeres siendo las metástasis la causa del 98% de las muertes.
El CM se clasifica en subtipos moleculares de acuerdo a la presencia/ausencia principalmente de receptores de estrógenos, receptor de progesterona y receptor del factor de crecimiento epidérmico humano 2 (HER2), también conocido como ErbB-2. Cada subtipo molecular de CM tiene su tratamiento específico, sin embargo, no todos los pacientes responden a la terapia y además, muchos pacientes que tienen una buena respuesta inicial adquieren luego resistencia. Todo esto lleva a la necesidad de desarrollar nuevos enfoques terapéuticos basados en estrategias de combinación de distintas drogas existentes o nuevas que aborden a la enfermedad actuando simultáneamente en diferentes vías cruciales para el crecimiento y la progresión tumoral.
Este grupo de trabajo procura estudiar nuevas terapias o nuevas combinaciones de terapias existentes para lograr inhibir de manera más efectiva la viabilidad, adhesión, migración e invasión de células de cáncer de mama humano.
Dra. Marina Inés Flamini – Lic. Fiorella Vanderhoeven
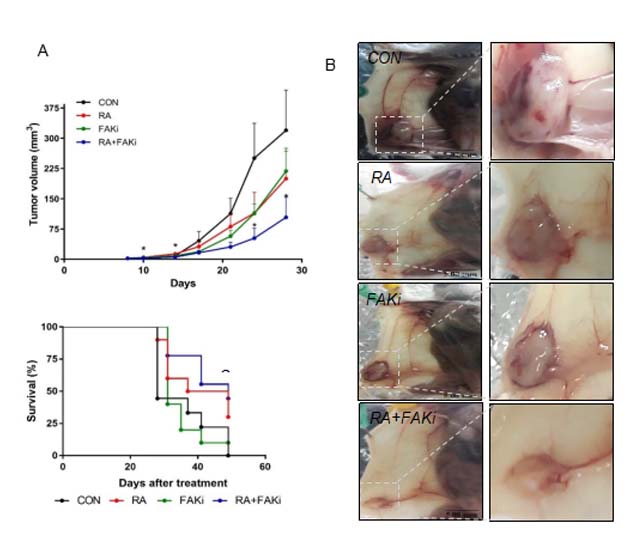
El ácido retinoico (RA), principal ligando de los receptores de ácido retinoico (RAR), es una molécula de señalización pleiotrópica, que regula programas genéticos críticos que controlan el desarrollo, homeostasis, proliferación, diferenciación, muerte celular y/o supervivencia. El RA y sus derivados han sido empleados como potenciales agentes quimioterapéuticos debido a sus efectos diferenciadores, antiproliferativos, proapoptóticos y antioxidantes. El uso de ácido retinoico fue aprobado hace más de 25 años en pacientes con leucemia promielocítica aguda, sin embargo, el uso del RA en cánceres sólidos sigue siendo controversial. Los ensayos clínicos realizados hasta el momento demostraron resultados desalentadores y resistencia al RA. En ensayos previos realizados por nuestro grupo observamos que el RA, participa en el proceso migración celular inhibiendo la expresión de proteínas implicadas en dicho proceso. En este proyecto consideramos crucial realizar nuevos estudios preclínicos sobre las vías moleculares que permitan superar la resistencia al RA, y asimismo determinar cuáles son las alteraciones moleculares que dotan a las células cancerígenas de capacidades metastásicas. Nuestro propósito consiste en poder contrarrestar los procesos migratorios e invasivos desregulados en CM mediante el uso de retinoides y/o inhibidores de quinasas, pretendemos determinar nuevos posibles marcadores y estrategias innovadoras para superar la resistencia a retinoides y proporcionar nuevos enfoques que justifiquen el diseño de nuevos ensayos clínicos.
Tenemos una vasta experiencia en diferentes vías, sólo por nombrar algunas: las kinasas FAK, c-SRC, PI3K, mTOR, ErbB-2.
Principales líneas de trabajo:
-
- Combinación de terapias dirigidas en el cáncer de mama HER2+: mecanismos de acción para contrarrestar la metástasis en cáncer de mama.
- Efecto no genómico del ácido retinoico en la migración e invasión de células de cáncer de mama.
- Regulación extragonadal de gonadotropinas: bases moleculares de la invasión y metástasis en cáncer de mama.
- Estudio de los principales pasos que promueven la adhesión, migración e invasión en cáncer de mama (cultivos celulares y modelo en animales), a través de mecanismos regulatorios de proteínas quinasas/fosfatasas moduladas por hormonas.
Algunas de las técnicas que empleamos de manera rutinaria en los diferentes proyectos: Cultivo celular, Ensayos de viabilidad e Interacción farmacológica, Inmunofloorescencias, Western Blot, Transfecciones/Silenciamientos, Ensayos de Adhesión/migración/Invasión, “In vivo” con ratones Balb-c: crecimiento ortotópico del tumor y capacidad espontánea de realizar metástasis, etc.