Ignacio Cebrián
LABORATORIO DE CÉLULAS DENDRÍTICAS Y PRESENTACIÓN CRUZADA DE ANTÍGENOS
Líneas de investigación
Nuestro grupo busca dilucidar los mecanismos moleculares que utilizan las células dendríticas para procesar y presentar antígenos exógenos. Este proceso inmunológico llamado presentación cruzada, es fundamental para establecer respuestas inmunes citotóxicas contra células tumorales y diversos microorganismos patógenos. En este contexto, las células dendríticas constituyen el tipo celular mejor adaptado para llevar a cabo la presentación cruzada de antígenos, ya que cuentan con importantes especializaciones de su vía endocítica. En el laboratorio nos resulta de particular interés comprender las complejas interacciones que se establecen entre los diferentes compartimientos endosomales durante el transporte intracelular de antígenos exógenos internalizados por las células dendríticas antes y después de su asociación con las moléculas MHC-I. La comprensión de estos procesos poco caracterizados del transporte endocítico en células dendríticas nos permitirá contar con nuevas herramientas de potencial aplicación en el campo de la inmunoterapia.
Rol de los endosomas de distribución y reciclaje durante la presentación cruzada
La etapa del transporte endocítico conocida como sorting o “de distribución” es especialmente compleja permitiendo el direccionamiento del material incorporado hacia los lisosomas o hacia vías de reciclaje. Muy poco se sabe sobre esta etapa crucial de la endocitosis en las células dendríticas. Por lo tanto, esta línea de investigación busca definir el papel que juegan los endosomas de distribución y reciclaje durante la presentación cruzada de antígenos. En trabajos recientes hemos demostrado que la GTPasa Rab22a, la cual regula la distribución y reciclaje de diferentes moléculas asociadas a membrana, juega un papel determinante para garantizar el correcto transporte intracelular de las moléculas MHC-I en las células dendríticas, y en consecuencia, la presentación cruzada de antígenos (Figura 1). Mediante el estudio de nuevos efectores moleculares que estamos abordando actualmente en el laboratorio obtendremos información complementaria y más detallada sobre la importancia de los endosomas de distribución y reciclaje durante la presentación cruzada en células dendríticas.
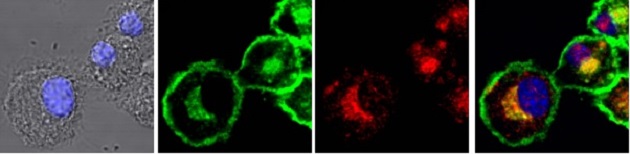
Figura 1. Distribución intracelular de Rab22a en células dendríticas. Inmunofluorescencia indirecta y microscopía confocal mostrando la colocalización de la GTPasa Rab22a (rojo) y las moléculas MHC-I (verde) en zona perinuclear coincidente con el centro de reciclaje. Los núcleos teñidos con DAPI (azul) y las imágenes de contraste de fase se observan en el panel de la izquierda. La superposición de todos los canales fluorescentes se muestra en el panel de la derecha.
Relevancia de la formación de cuerpos multivesiculares durante la presentación cruzada de antígenos
Otro aspecto fundamental de la vía endocítica que hasta el momento ha sido poco estudiado en el contexto del tráfico intracelular y la presentación de antígenos exógenos es la formación de vesículas intraluminales. Luego de la fusionarse con distintos compartimientos en el proceso de maduración, los endosomas ganan más membrana que volumen contenido. Esto hace que se pierda su estructura esférica inicial y se formen extensiones tubulares e invaginaciones globulares, tomando el aspecto de un cuerpo multivesicular (multivesicular bodies, MVBs). De esta manera, el material contenido comienza a separarse para el reciclaje en los túbulos, o bien para la degradación en vesículas internas. Resultados recientes obtenidos por nuestro grupo de trabajo sugieren un papel fundamental para los MBVs durante el tráfico intracelular de las moléculas MHC-I en células dendríticas. Mediante la utilización de la droga U-18666A, la cual funciona como inhibidor de MVBs interfiriendo en la síntesis de colesterol y alterando la membrana y función de proteínas residentes, observamos que las células dendríticas tratadas con U-18666A presentan un marcado defecto para llevar a cabo la presentación cruzada de antígenos solubles, particulados y asociados al parásito intracelular Toxoplasma gondii (Figura 2). Estudios en curso nos permitirán comprender de manera más precisa el rol de los MBVs durante la presentación cruzada de antígenos y también nos brindarán un panorama más completo de los actores moleculares involucrados en este proceso.
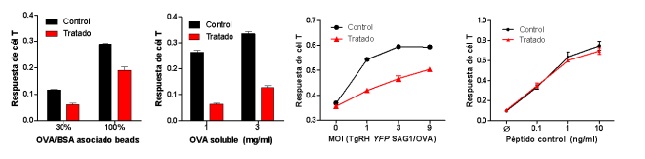
Figura 2. Efecto del inhibidor U-18666A sobre la presentación cruzada de antígenos. Células dendríticas fueron pre-tratadas con el inhibidor U-18666A y mantenidas con la droga durante el tiempo de internalización de antígenos A) particulados, B) solubles, C) asociados a Toxoplasma gondii y D) con el péptido control SIINFEKL. Se puede observar que la presentación cruzada está fuertemente afectada por el tratamiento con la droga (rojo) en relación a las células dendríticas sin tratar (negro). Este defecto en la activación de los linfocitos T CD8+ se evidencia con todos los antígenos exógenos utilizados excepto el péptido control, el cual no debe ser procesado al interior de la célula dendrítica.
Equipo de Trabajo
Ignacio Cebrián
Cristina Celeste Croce
Sofía Dinamarca
Personal de apoyo técnico:
- Daniela Pastor (Técnico Asociado – CONICET)
- Rodrigo Militello (Profesional Adjunto – CONICET)
- Marcelo Furlán (Profesional Principal – CONICET)
Grupos colaboradores
– Dr. Nicolas Blanchard. Eukariotic intracellular parasites: immunity and chemoresistance. Centre de Physiopathologie Toulouse Purpan, Francia. Interactions between dendritic cells and Toxoplasma gondii parasites: role of membrane trafficking in dendritic cells.
– Dra. Paula Molinari. Instituto de Agrobiotecnología y Biología molecular. INTA Castelar, Buenos Aires, Argentina. Tráfico intracelular de los baculovirus durante la infección de células dendríticas y su potencial aplicación para el desarrollo de vacunas de interés veterinario.
– Dra. Leticia Bentancor. Laboratorio de Ingeniería Genética y Biología celular y molecular. Universidad Nacional de Quilmes, Buenos Aires, Argentina. Estudio del bacteriófago implicado en la expresión de la toxina Shiga en células dendríticas.
– Dra. Teresa Damiani. Instituto de Medicina y Biología experimental de Cuyo (IMBECU – CONICET), Mendoza, Argentina. Rab GTPasas involucradas en la infección de células dendríticas por Chlamydia trachomatis.
Publicaciones seleccionadas
Mayorga LS and Cebrian I*. Rab22a: a novel regulator of immune functions. Molecular Immunology, 2018. doi: 10.1016/j.molimm.2018.03.028. *Corresponding author.
Croce C, Mayorga LS and Cebrian I*. Differential requirement of Rab22a for the recruitment of ER-derived proteins to phagosomes and endosomes in dendritic cells. Small GTPases, 2017. 29:1-9. doi: 10.1080/21541248.2017.1384088. *Corresponding author.
Cebrian I*, Croce C, Guerrero N, Blanchard N and Mayorga LS*. Rab22a controls MHC-I intracellular trafficking and antigen cross-presentation by dendritic cells. EMBO Reports, 2016. 17(12): 1753-1765. *Corresponding authors.
Cebrian I, Visentin G, Blanchard N, Jouve M, Bobard A, Moita C, Enninga J, Moita LF, Amigorena S and Savina A. Sec22b regulates phagosomal maturation and antigen crosspresentation by dendritic cells. Cell, 2011. 147(6): 1355-68.
Savina A*, Peres A*, Cebrian I, Carmo N, Moita C, Hacohen N, Moita LF and Amigorena S. The small GTPase Rac2 controls phagosomal alkalinization and crosspresentation selectively in CD8+ dendritic cells. Immunity, 2009. 17; 30 (4): 544-55. *Equal contribution.
Fuentes de financiamiento
– PICS 2017 (IR: Nicolas Blanchard, colaboración CNRS – CONICET).
– PICT 2016 (IR: Ignacio Cebrián).
– PIP 2014 (IR: Paula Molinari e Ignacio Cebrián)
